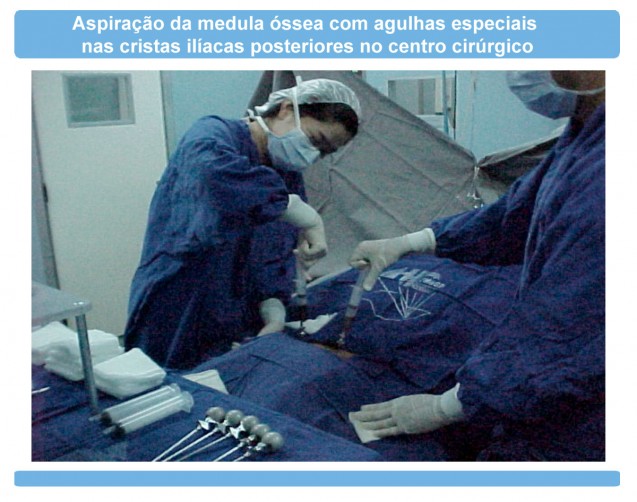
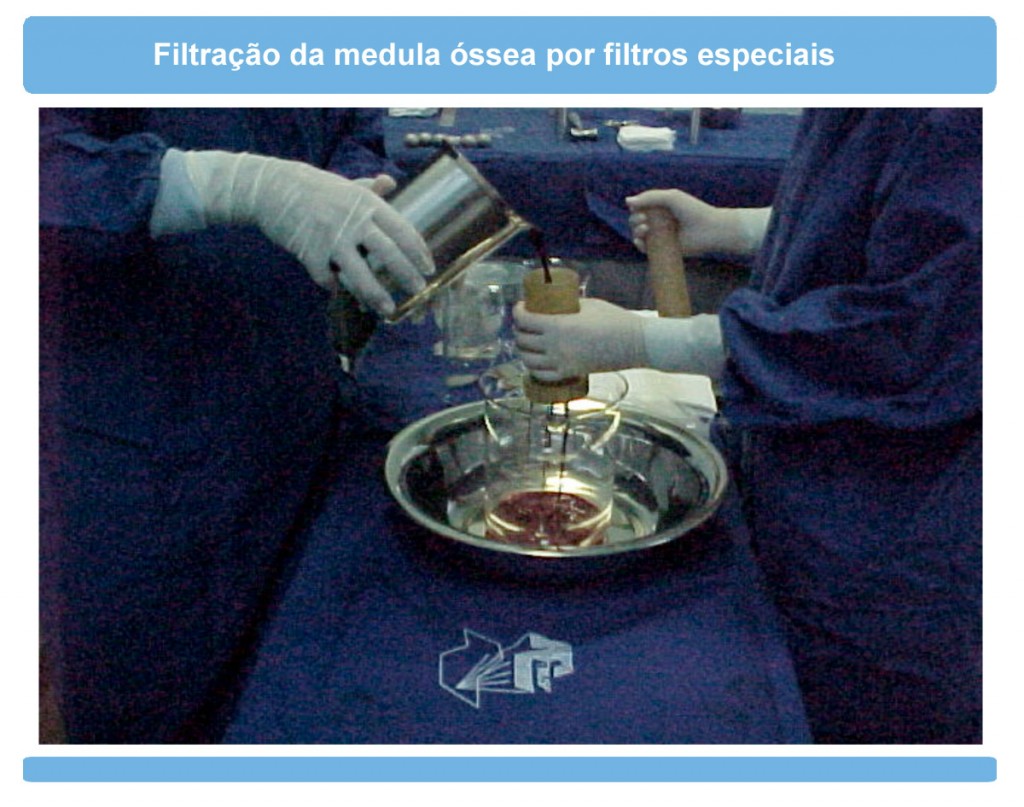
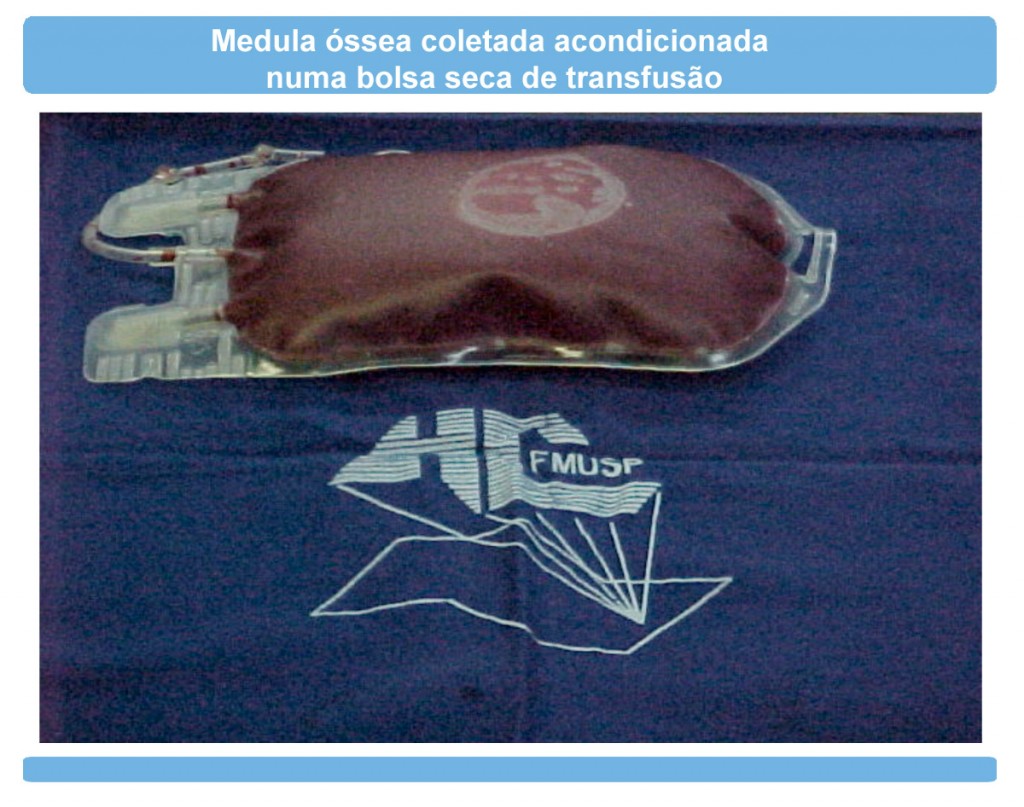
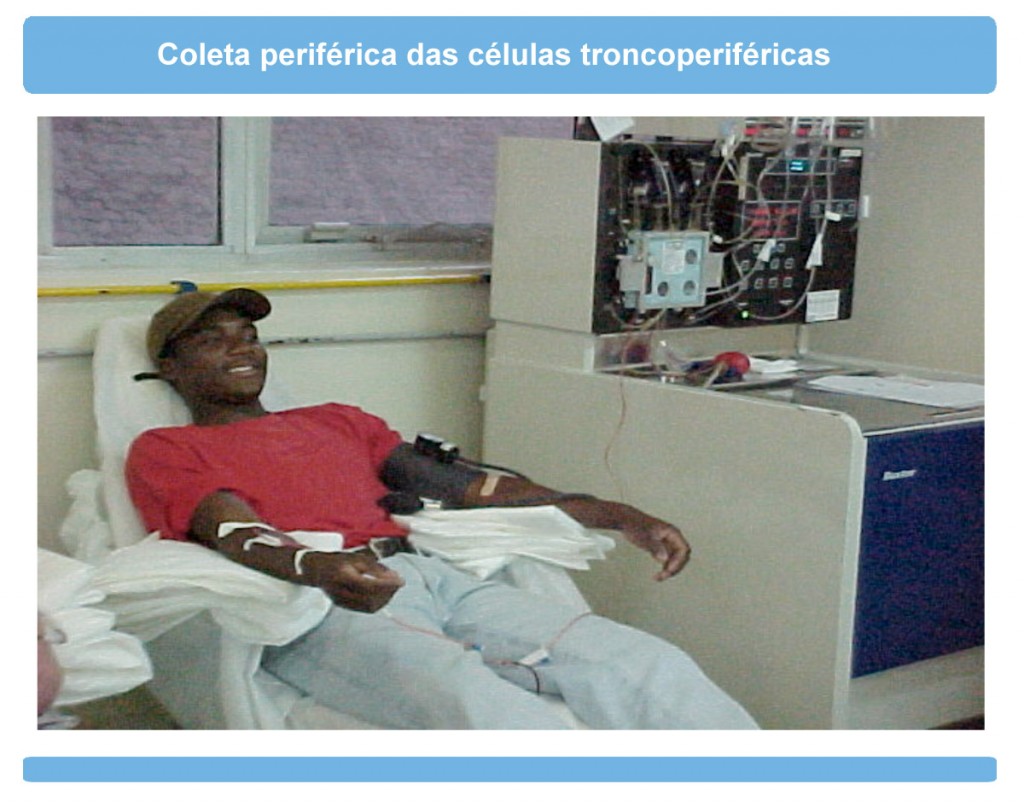
Orientações para o retorno das atividadesO que é a DECH (Doença do Enxerto Contra o Hospedeiro)?
O transplante de células-tronco hematopoéticas, popularmente conhecido como transplante de medula óssea, é um tipo de tratamento proposto para algumas doenças que afetam as células do sangue, como leucemias e linfomas. No entanto, apesar dos avanços médicos, o transplante não está isento de complicações. Uma das mais temidas é a Doença do Enxerto Contra o Hospedeiro, ou DECH.
A DECH é uma condição complexa e potencialmente grave que ocorre após o transplante alogenico, na qual as células do enxerto (células-tronco transplantadas) atacam os tecidos do paciente receptor, considerados como “hospedeiro”. Essa reação é desencadeada quando o sistema imunológico das células do enxerto identifica os tecidos do paciente como estranhos e inicia uma resposta inflamatória.
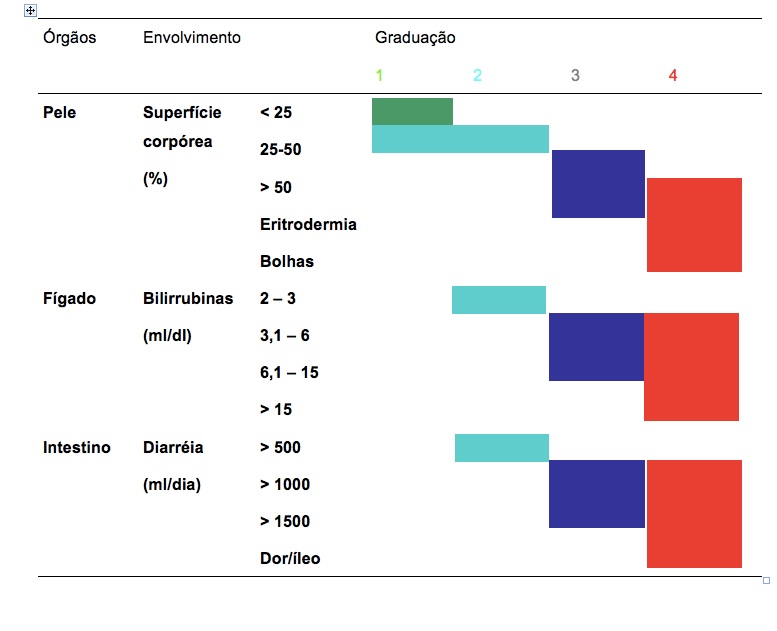
Os sintomas da DECH podem variar, desde leves a potencialmente fatais, dependendo do tipo e da gravidade. Entre os sinais mais comuns estão erupções cutâneas, diarreia, náuseas, vômitos, icterícia (coloração amarelada da pele e dos olhos, entre outros.
O diagnóstico da DECH é realizado através da avaliação clínica, análises laboratoriais, biópsias de pele e outros órgãos afetados. O acompanhamento frequente e monitoramento rigoroso após o transplante são fundamentais para detectar precocemente a DECH e iniciar o tratamento adequado.
O tratamento da DECH pode incluir a administração de medicamentos imunossupressores para diminuir a resposta do sistema imunológico e reduzir a inflamação. Em casos graves, pode ser necessário corticosteróides ou terapias mais intensivas, como imunoglobulinas.
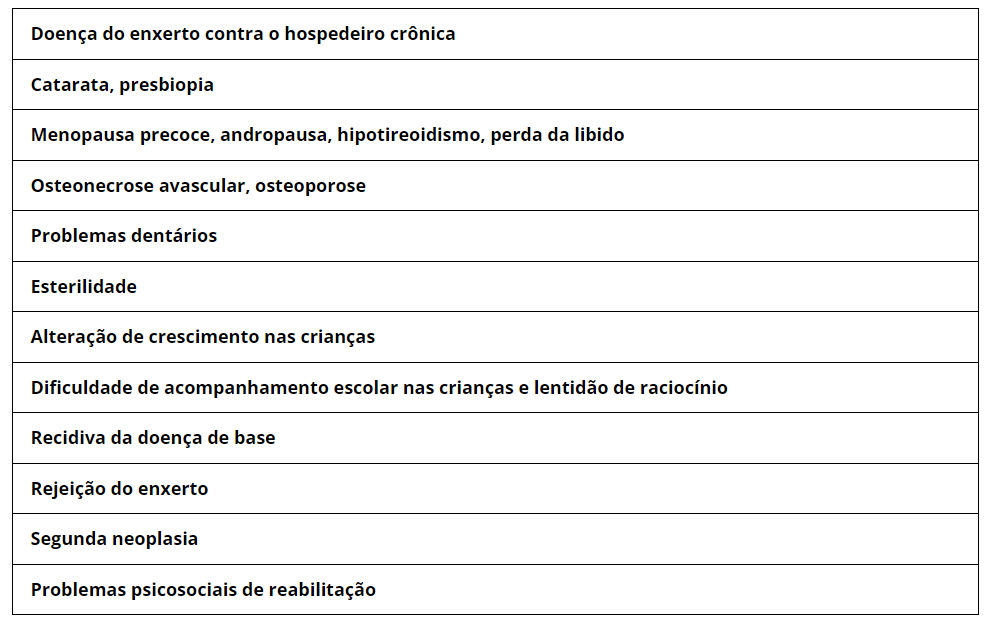
A prevenção da DECH é uma das principais áreas de pesquisa na medicina do transplante. Os avanços nesse campo têm se concentrado em técnicas de compatibilidade de doadores, terapias farmacológicas e tratamentos imunossupressores personalizados.
O acompanhamento próximo com a equipe médica especializada é fundamental para identificar precocemente a DECH e tomar as medidas adequadas para tratamento e manejo.
A pesquisa contínua e os avanços na medicina do transplante estão oferecendo esperança para melhorar a prevenção e o tratamento da DECH, tornando essa terapia cada vez mais segura e eficaz, oferecendo novas perspectivas para pacientes que enfrentam doenças hematológicas graves.