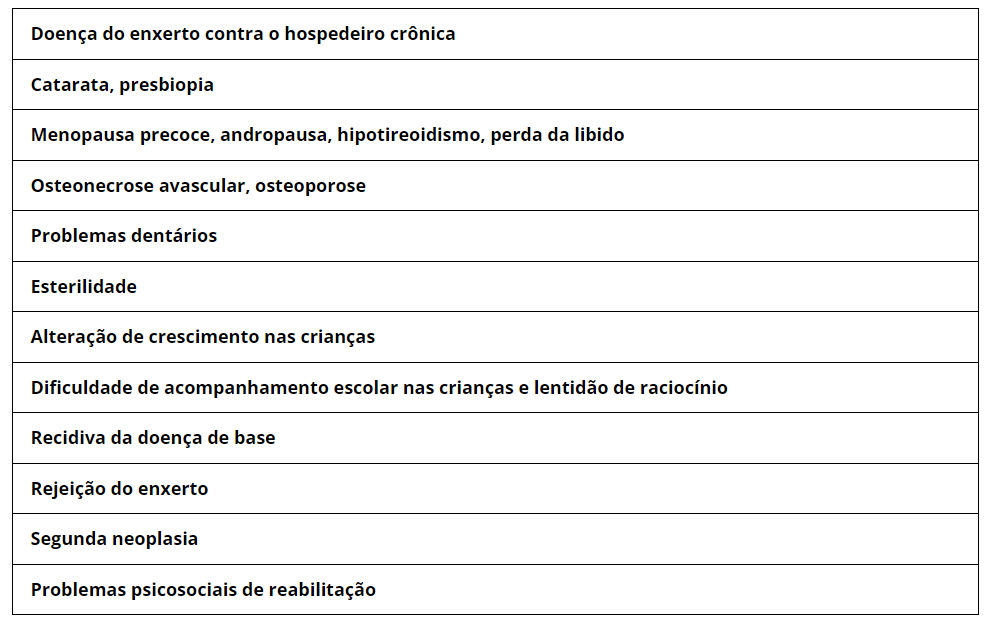
A pele é o órgão mais freqüentemente acometido com lesões que vão desde pápulas liquenóides, áreas de eritema focal, hiper ou hipopigmentação, até formas extensas graves, nos quais a pele torna-se difusamente espessada, fibrótica, dando origem ‘as contraturas e limitações de movimento.
O envolvimento do trato gastrintestinal é freqüente, na cavidade oral podem surgir líquen plano, estrias, placas, atrofia, eritema da mucosa oral, jugal e língua. Em formas mais graves, o tubo digestivo pode sofrer fibrosamento, tornando-se rígido, sem haustrações, acarretando síndromes disabsortivas.
Uma outra complicação comum da DECH crônica é a síndrome sicca que pode acometer os olhos, cavidade oral, vagina e produção espermática. Há por vezes, necessidade de lágrimas e salivas artificiais, além de lubrificantes vaginais.
O pulmão é outro órgão que pode ser envolvido, na forma de bronquiolite obliterante ou bronquiolite obliterante com pneumonia em organização. O quadro repercute em obstrução da saída do ar pelos pulmões e o quadro clínico assemelha-se a de um asmático, com sibilância, estertorações, chiados, dispnéia. Além do tratamento imunossupressor, são combinados broncodilatadores, e muitas vezes antimicrobianos e fisioterapia respiratória.
A DECH crônica causa retardo na recuperação imunológica, com alteração dos níveis de imunoglobulinas, disfunção das citocinas, prejuízo da opsonização, retardo na migração dos granulócitos, propiciando desta forma, o aumento nos índices de infecção.
A DECH crônica é geralmente tratada com sucesso, com fármacos imunossupressores combinados, que permitem ao paciente boa qualidade de vida, integração social e retorno ao trabalho.
Vale a pena salientar que a DECH crônica tem papel crucial na sustentação da remissão completa do paciente com doença oncohematológica, pois os linfócitos do doador protegem o paciente não reconhecendo o clone tumoral com “ self ”. Portanto, o transplante alogênico sustenta a remissão e cura do doente utilizando a imunologia a seu favor também, além de tudo o que foi exposto.
Recentemente em trabalho publicado em 2005/2006, um grupo de transplantadores dos EUA, em especial do Fred Hutchinton Cancer Research Center – em Seattle, se reuniram, para tentar criar um sistema de “score” que denote a extensão e a severidade da DECH crônica, definina DECH crônica mínima e determine melhor o tratamento tópico ou sistêmico, e traduza a realidade clínica do paciente e suas limitações, contraturas,etc.
Estas recomendações ainda aguardam validação prospectiva, mas podem ser sumarizadas em três itens:
a) diferenciação da DECH aguda;
b) presença de pelo menos um diagnóstico/sinal clínico de DECH crônica ou presença de pelo menos uma manifestação documentada por biópsia ou exame de pesquisa específico( histológico, radiológico, funcional);
c) exclusão de outro diagnóstico possível.
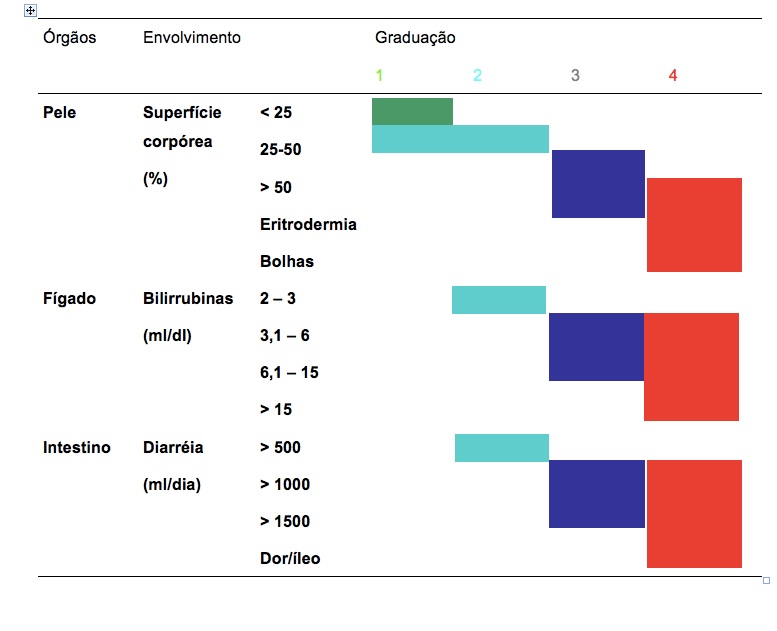
Cada órgão avaliado recebe avaliação do envolvimento, se ausente, leve, moderado e severo ( “score” 0, 1,2 e 3).
A soma dos pontos de cada órgão classificará o paciente em DECH crônica leve, moderada e grave.
DECH leve foi definida como envolvendo 1 ou 2 órgãos, exceto pulmão, com “score” máximo de 1 dado para cada órgão.
DECH moderada – pelo menos um órgão ou sítio com “score” de 2 ou 3 ou mais órgãos acometidos com “score” de 1.
DECH severa – “score 3” em qualquer órgão ou sítio – indicando disabilidade maior.
Para os pulmões a classificação “score” 1 é traduzida como moderada e para “score” 2 como DECH severa.
Para as formas moderadas e severas a imunossupressão sistêmica deve ser considerada. Os órgãos a serem avaliados são: pele, unhas, cabelo e fâneros, boca, olhos, genitália, trato digestivo,fígado, pulmão, sistema osteoarticular e muscular, sistema hematopoético e imune, e outros( neuropatia periférica, síndrome nefrótica, miastenia gravis, condução cardíaca anômala ou cardiomiopatia, derrames pleurais, autoanticorpos).